|
ѕрактикумы
 —еминары
—еминары
 ¬ебинары
¬ебинары
 »сследовательска€ работа
»сследовательска€ работа
 Ёкспедиции и лагер€
Ёкспедиции и лагер€
 Ёкотропы
Ёкотропы
 Ёкологические игры
Ёкологические игры
 ѕубликации
ѕубликации
  ѕриведенна€ ниже работа была
опубликована в журнале "»сследовательска€
работа школьников" »здательского дома
"Ќародное образование" и была любезно
предоставлена главным редактором журнала ќ.¬.√лушенковым
в 2017 году.
ѕриведенна€ ниже работа была
опубликована в журнале "»сследовательска€
работа школьников" »здательского дома
"Ќародное образование" и была любезно
предоставлена главным редактором журнала ќ.¬.√лушенковым
в 2017 году.
»з огромного количества статей, опубликованных
в журнале за годы его работы в 2011-2016 гг, мы
отобрали публикации в области экологии, биологии,
географии и краеведени€, а также небольшое число
работ по археологии, истории и культуре.
ƒл€ облегчени€ поиска и навигации по
данному разделу, все работы сгруппированы по
нескольким нижеследующим рубрикам:
 ќбщие вопросы - теори€, ќбщие вопросы - теори€,
 ќбщие вопросы - практика, ќбщие вопросы - практика,
 √еографи€, √еографи€,
 Ѕиологи€, Ѕиологи€,
 Ёкологи€ - теори€, Ёкологи€ - теори€,
 Ёкологи€ - практика, Ёкологи€ - практика,
 ƒетские исследовательские работы и проекты по географии, биологии и экологии ƒетские исследовательские работы и проекты по географии, биологии и экологии
ѕримечани€: 1) приведенна€ ниже работа размещена на нашем сайте в оригинальном виде, т.е. так, как она была предоставлена дл€ публикации в журнале; 2) автор сайта не несет ответственности за достоверность сведений, изложенных в работе; 3) данна€ работа €вл€етс€ авторской и ее перепечатка возможна только с указанием авторов и активной гиперссылкой на наш сайт.
»сследование стабильности коэнзима Q10 в Ѕјƒ Ђ удесанї
в зависимости от услови€ хранени€ методом высокоэффективной жидкостной хроматографии
ќльга “ихонова
ћЅќ” —ќЎ є 11, г. ќбнинск, алужска€ область
–уководитель: к.х.н. ѕашкова ≈.Ѕ.,
ќќќ ЂЅ»ќЌї
1. ¬ведение
”бихиноны (коферменты Q) были обнаружены в 1967 году, и уже через несколько лет получили широкое применение в качестве антиоксидантов. ¬ последнее дес€тилетие была установлена св€зь между содержанием убихинона и нарушени€ми в де€тельности сердечно-сосудистой системы. насто€щему моменту разработано большое количество биологически активных добавок, косметических и лекарственных препаратов, содержащих в своем составе кофермент Q10, характерный дл€ организма человека.
”бихиноны посто€нно синтезируютс€ в организме из тирозина либо фенилаланина [1]. Ѕольше всего их в органах с активным метаболизмом Ц сердце, печени, селезенке и мозге. —уммарный уровень коэнзима Q10 достигает своего максимума к 20 годам и затем постепенно снижаетс€ с возрастом [1]. ѕоэтому необходимо поступление коэнзима Q10 в организм человека с пищей либо при помощи биологически активных добавок (Ѕјƒов). —одержание коэнзима Q10 в продуктах питани€ относительно невелико. Ќапример, в шпинате (продукт, наиболее богатый коэнзимом) его содержание составл€ет всего лишь 200 мкг/г. ¬ м€сных и рыбных продуктах (гов€дина, свинина, морска€ рыба) количество Q10 находитс€ на уровне 10-20 мкг/г [приложение 1]. ѕоэтому наиболее удобным источником коэнзима €вл€ютс€ разнообразные биологические добавки.
ќдной из таких Ѕјƒ, содержащих коэнзим Q10 €вл€етс€ Ђ удесанї. ¬ нем содержитс€ 30 мг/мл коэнзима Q10 (как за€влено производителем). Ќо при этом в сопроводительной документации не указаны услови€ хранени€ Ѕјƒ Ђ удесанї. ƒостоверно не известно, мен€етс€ ли концентраци€ коэнзима в образце с течением времени приема препарата (35Ц40 дней). —оответственно, целью моей работы €вл€лось исследование стабильности коэнзима Q10 в Ѕјƒ на прот€жении этого времени, а также выбор оптимальных условий хранени€ вскрытой упаковки.
ƒл€ этого необходимо было решить следующие задачи:
- »зучить существующие методы определени€ коэнзима Q10 в различных объектах;
- –азработать методику определени€ Q10 в Ѕјƒ Ђ удесанї;
- »сследовать стабильность коэнзима при различных услови€х хранени€.
- Ћитературный обзор
”бихиноны представл€ют собой 2,3-диметокси-5-метил-1,4-бензохиноны с полипренильной цепочкой различной длины в шестом положении (рис. 1). Ќа основании рекомендации IUPAC убихиноны обозначают как Qn, где n Ц число изопреновых звеньев в боковой цепи. ¬се изопреновые звень€ в молекуле наход€тс€ в транс-положении. “ака€ структура придает убихинону высокое сродство к клеточным мембранам [2].
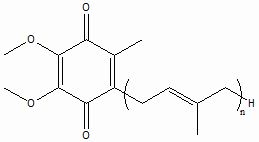
–ис. 1. —труктурна€ формула убихинона.
ќдной из функций коэнзимов Q в организме €вл€етс€ перенос электронов при синтезе ј“‘ на мембранах митохондрий [3]. Ќе менее важной €вл€етс€ его роль как жирорастворимого антиоксиданта. ¬осстановленна€ форма Ц убихинол Ц обладает способностью захватывать пероксидные радикалы (LOO∙), защища€ таким образом клетки.
QnH 2 + 2LOO· = Qn + 2LOOH
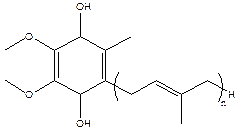
–ис. 2. —труктурна€ формула убихинола.
—оотношение окисленной и восстановленной формы посто€нно вне зависимости от того, в какой форме коэнзим поступает в организм человека. Ќарушение этого соотношени€ может свидетельствовать о заболевани€х обмена веществ, а также проблемах с сердечно-сосудистой системой [1].
¬се убихиноны нерастворимы в воде, зато раствор€ютс€ в большинстве органических растворителей. —оответственно, Ѕјƒ, в состав которых вход€т коэнзимы, должны в своей основе содержать значительное количество либо спирта, либо растительных масел. Ђ удесанї €вл€етс€ достаточно сложной многокомпонентной системой. ¬ его состав, помимо коэнзима, вход€т добавки жирорастворимых витаминов, растительные масла, эмульгаторы и консерванты. “аким образом, выбранный дл€ анализа метод определени€ Q10 должен быть достаточно селективным.
»сход€ из литературных данных, дл€ определени€ коэнзимов Q примен€ют три основные группы методов: электрохимические, спектрофотометрические и хроматографические [2]. ќднако электрохимический метод требует сложной пробоподготовки, а спектрофотометрический метод хоть и €вл€етс€ дешевым и быстрым, но не обладает достаточной селективностью. ѕоэтому выбрали метод высокоэффективной жидкостной (жидкостнотвердофазной) хроматографии.
’роматографи€ Ц физико-химический метод разделени€ веществ в динамических услови€х. омпоненты раздел€емой смеси распредел€ютс€ между двум€ фазами, неподвижной и подвижной (элюент). Ќеподвижна€ фаза представл€ет собой сорбент с развитой поверхностью, а подвижна€ Ц поток газа (пара, флюида Ц вещества в сверхкритическом состо€нии) или жидкости. ѕоток подвижной фазы фильтруетс€ через слой сорбента или перемещаетс€ вдоль сло€ сорбента [4].
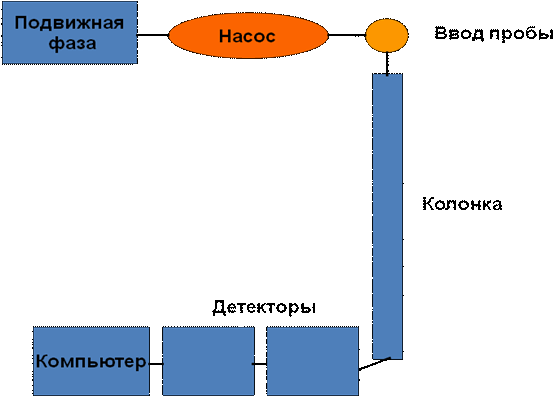
–ис. 3. —хема жидкостного хроматографа
ѕодвижна€ фаза (элюент) прокачиваетс€ насосом через хроматографическую колонку, где, собственно, и происходит разделение компонентов пробы. ƒалее вещества вместе с током подвижной фазы попадают в детектор, который дает отклик (аналитический сигнал) на их присутствие в элюате. ѕодвижна€ фаза может состо€ть из одного или нескольких растворителей, причем их концентраци€ в ходе анализа может оставатьс€, как посто€нной (изократический вариант), так и мен€тьс€ по заданной программе (градиентный режим). ¬вод пробы осуществл€етс€ либо вручную, либо при помощи специального устройства дл€ автоматического ввода Ц автосэмплера. ”правление всеми модул€ми прибора, сбор и обработка данных осуществл€ютс€ с помощью компьютера и набора соответствующих программ. ¬се детекторы можно разделить на селективные (которые чувствительны только к определенным классам химических соединений) и универсальные (дающие отклик на широкий круг веществ). ¬ литературе описано большое количество различных вариантов детектировани€, примен€емых при хроматографическом определении коэнзима Q10.
¬ последнее врем€ широкое распространение получило масс-спектрометрическое детектирование. ≈го принцип основан на том, что все соединени€, содержащиес€ в элюате, ионизируютс€, и прибор регистрирует ион с определенным значением масса/зар€д (m/z). Ёто значение €вл€етс€ уникальным дл€ каждого соединени€, что обуславливает очень высокую селективность и чувствительность определени€. ћетод ¬Ё∆’ с масс-спектрометрическим детектированием активно используетс€ при клинических исследовани€х, при работе со сложными биологическими образцами (плазма крови, ткани органов) [4]. »з минусов такого оборудовани€ в первую очередь нужно отметить высокую цену и трудности в эксплуатации.
Ќаличие хинольной группировки в составе коэнзимов Q10 делает возможным использование электрохимического детектировани€. ¬ этом случае регистрируетс€ переход от восстановленной формы коэнзима к окисленной. Ќо такой вариант детектировани€ требует достаточно сложного оборудовани€, например, детектор с двойной €чейкой [5].
Ќаиболее простой, доступный и распространенный вариант Ц спектрофотометрическое детектирование. ≈динственный недостаток этого метода заключаетс€ в низкой селективности детектировани€, поэтому необходимо предварительное полное разделение всех компонентов анализируемой смеси.
“аким образом, дл€ нашей работы мы выбрали самый доступный и распространенный спектрофотометрический детектор.
3. Ёкспериментальна€ часть
јнализ проводили на жидкостном хроматографе Acella 600 (Thermo, —Ўј). ’роматограф состо€л из градиентного насоса, он-лайн дегазатора подвижной фазы, автосэмплера, термостата колонок и диодно-матричного детектора. –азделение проводили на колонке Luna C18(2) размером 2,0 × 100 мм, размер зерна сорбента 1,9 мкм ( Phenomenex, √ермани€). ”правление хроматографом и обработку данных проводили с помощью программного комплекса Xcalibur.
ƒл€ приготовлени€ подвижной фазы использовали растворители класса Ђ gradient gradeї производства компании Panreac (»спани€).
¬звешивание стандартных образцов проводили на весах Mettler Toledo H700, точность которых составл€ла 0,00001 г.
–азбавление растворов проводили с помощью автоматических дозаторов Eppendorf с рабочим диапазоном 100-1000 и 20-200 мкл. ƒопустима€ погрешность измерени€ составл€ла не более 5%.
- –езультаты и их обсуждение
ѕодбор и оптимизаци€ условий хроматографического разделени€.
ѕоскольку коэнзим имеет пол€рную структуру, дл€ разделени€ смеси выбрали вариант обращено-фазовой хроматографии. ¬ данном режиме неподвижна€ фаза €вл€етс€ менее пол€рной в сравнении с подвижной.
¬следствие гидрофобности коэнзима Q10 следует ожидать, что он будет удерживатьс€ на непол€рной колонке в течение длительного времени, поэтому в качестве элюента необходим растворитель или смесь растворителей с высокой элюирующей способностью. ¬ литературе описываютс€ подвижные фазы на основе изопропилового спирта [6], но в€зкость таких растворов и, соответственно давление, которое нужно приложить, чтобы прокачать элюент через колонку, велико [7]. ѕоэтому к изопропанолу добавл€ли растворитель, обладающей меньшей в€зкостью и хорошо смешивающийс€ с ним Ц ацетонитрил.
Ќа первом этапе работы выбрали оптимальное соотношение компонентов в подвижной фазе. »зопропиловый спирт и ацетонитрил смешивали в определенных пропорци€х, уравновешивали систему в течение 10 минут и вводили в прибор образец Ѕјƒ Ђ удесанї, разбавленный в 10 раз подвижной фазой. ƒетектирование осуществл€ли спектрофотометрически при длине волны 275 нм (подбор условий детектировани€ см. далее). «ависимость времени удерживани€ коэнзима Q10 от концентрации изопропилового cпирта в подвижной фазе показана на рис. 4.
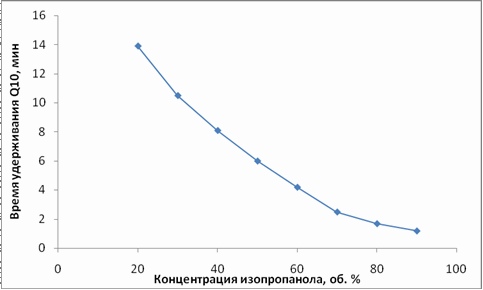
–ис. 4 «ависимость времени удерживани€ коэнзима Q10 от содержани€ изопропилового спирта в подвижной фазе.
Ќа рис. 4 видно, что при содержании изопропилового спирта в смеси 90 % и больше, пик коэнзима выходит вместе с мертвым временем (врем€ выхода неудерживаемых компонентов). ѕри концентрации изопропанола в диапазоне от 70 до 90% пик коэнзима перекрываетс€ с пиками примесей - других составл€ющих Ђ удесанї [приложение 2]. ѕри 60 % изопропилового спирта все пики хорошо разрешены, вместе с тем, анализ занимает очень мало времени (не более 5 минут). ѕри концентрации изопропанола до 60 %,пики хорошо разрешены, но анализ занимает неоправданно много времени. ѕоэтому дл€ всех дальнейших экспериментов использовали подвижную фазу состава изопропиловый спирт : ацетонитрил Ц 60:40. —корость потока подвижной фазы составила 400 мкл/мин. ’роматограмма модельного раствора коэнзима Q10 представлена на рис.5.
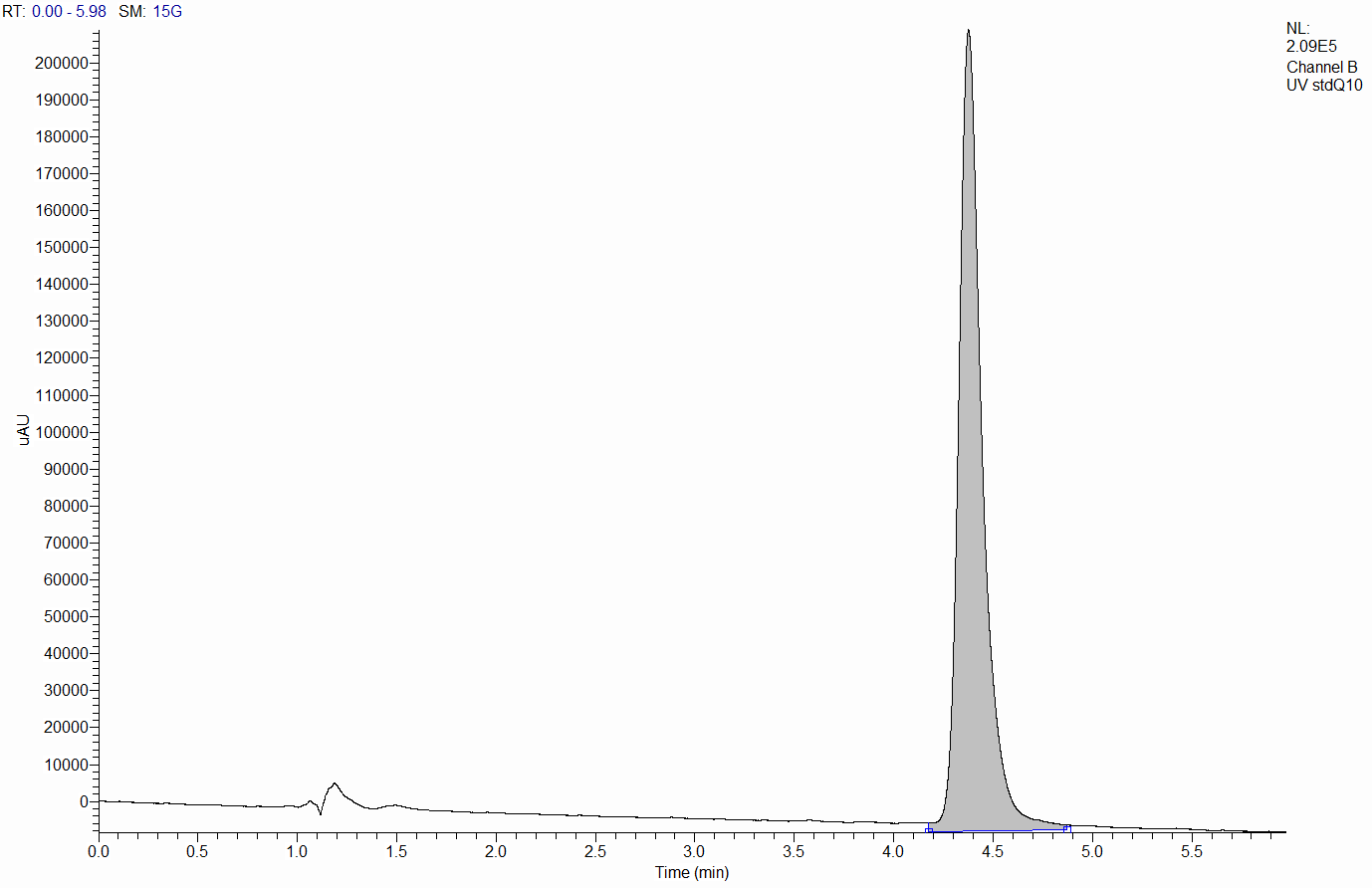
–ис.5. ’роматограмма модельного раствора Q10. онцентраци€ коэнзима 0.5 мг/мл.
— помощью диодно-матричного детектора были изучены спектры поглощени€ стандартного раствора коэнзима Q10.
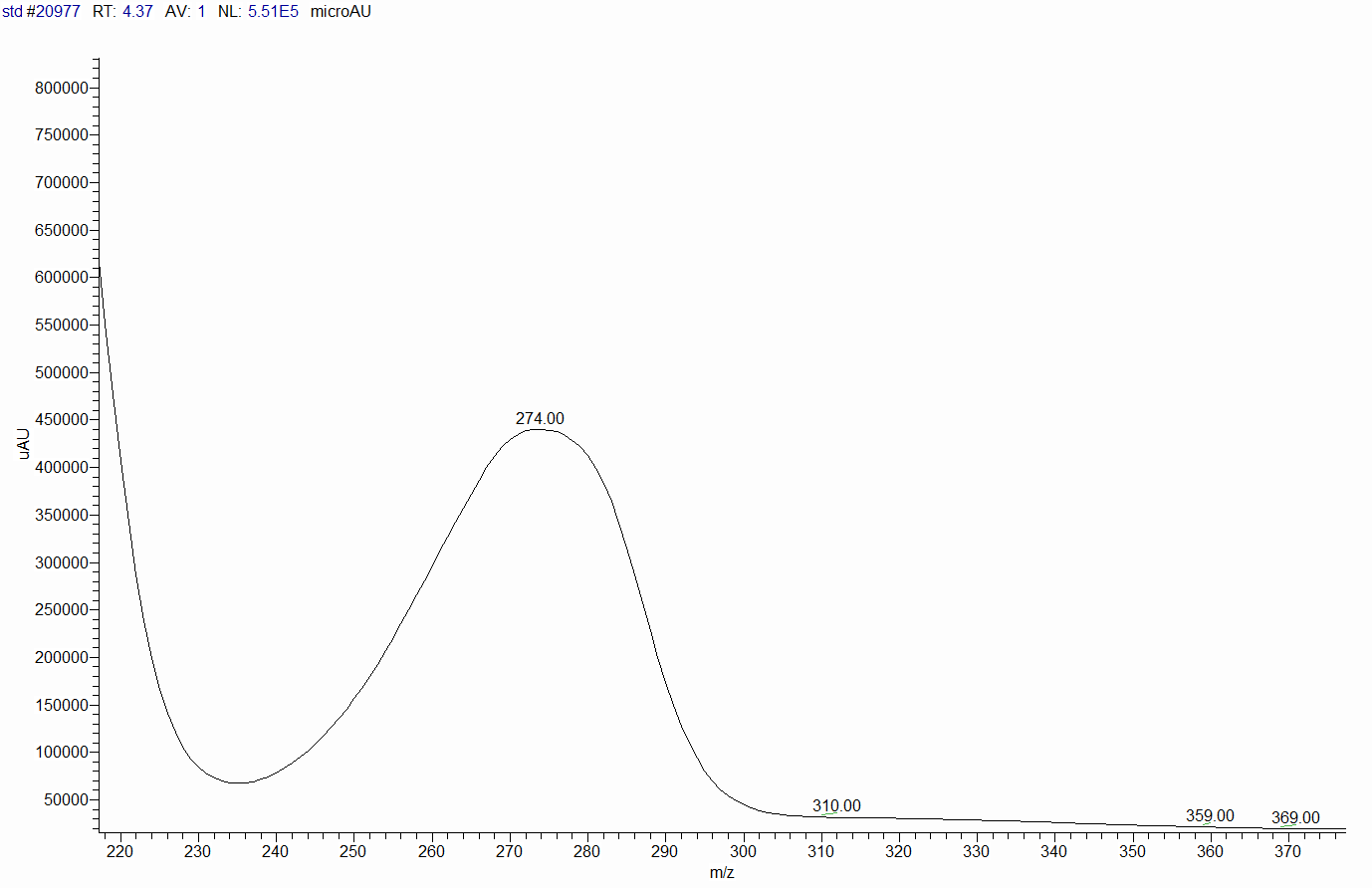
–ис.6 —пектр поглощени€ раствора Q10. онцентраци€ коэнзима 0,5 мг/мл.
ѕри подборе колонки учитывали строение определ€емого соединени€, чтобы соединение на ней задерживалось, т.е. сорбировалось. ≈сли оно не будет задерживатьс€, взаимодействовать с неподвижной фазой внутри колонки, то вводима€ смесь веществ, не разделитьс€ и на хроматограмме не будет разделени€ пиков. ћолекула коэнзима гидрофобна€, поэтому подобрали колонку, заполненную гидрофобным сорбентом. —амый распространенный, изученный и доступный вариант Ц силикагель с привитым к нему гидрофобным углеводородным радикалом —18 (рис. 7).
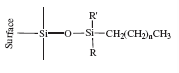
–ис.7. —труктурна€ формула модифицированного силикагел€
ѕеред анализом образец Ђ удесанаї разводили в 100 раз подвижной фазой дл€ того, чтобы концентраци€ коэнзима в пробе была не такой большой. ƒетектор при концентрации 30 мг/л просто зашкалит, и мы не сможем правильно посчитать концентрацию, отклик не будет пропорционален количеству определ€емого вещества. роме этого неразбавленный Ђ удесанї имеет большую в€зкость, что мешает осуществить воспроизводимый ввод пробы.
ƒетектирование проводили с использованием спектрофотометрического детектора (он измер€ет поглощение жидкости, котора€ через него проходит) на длине волны 275 нм.
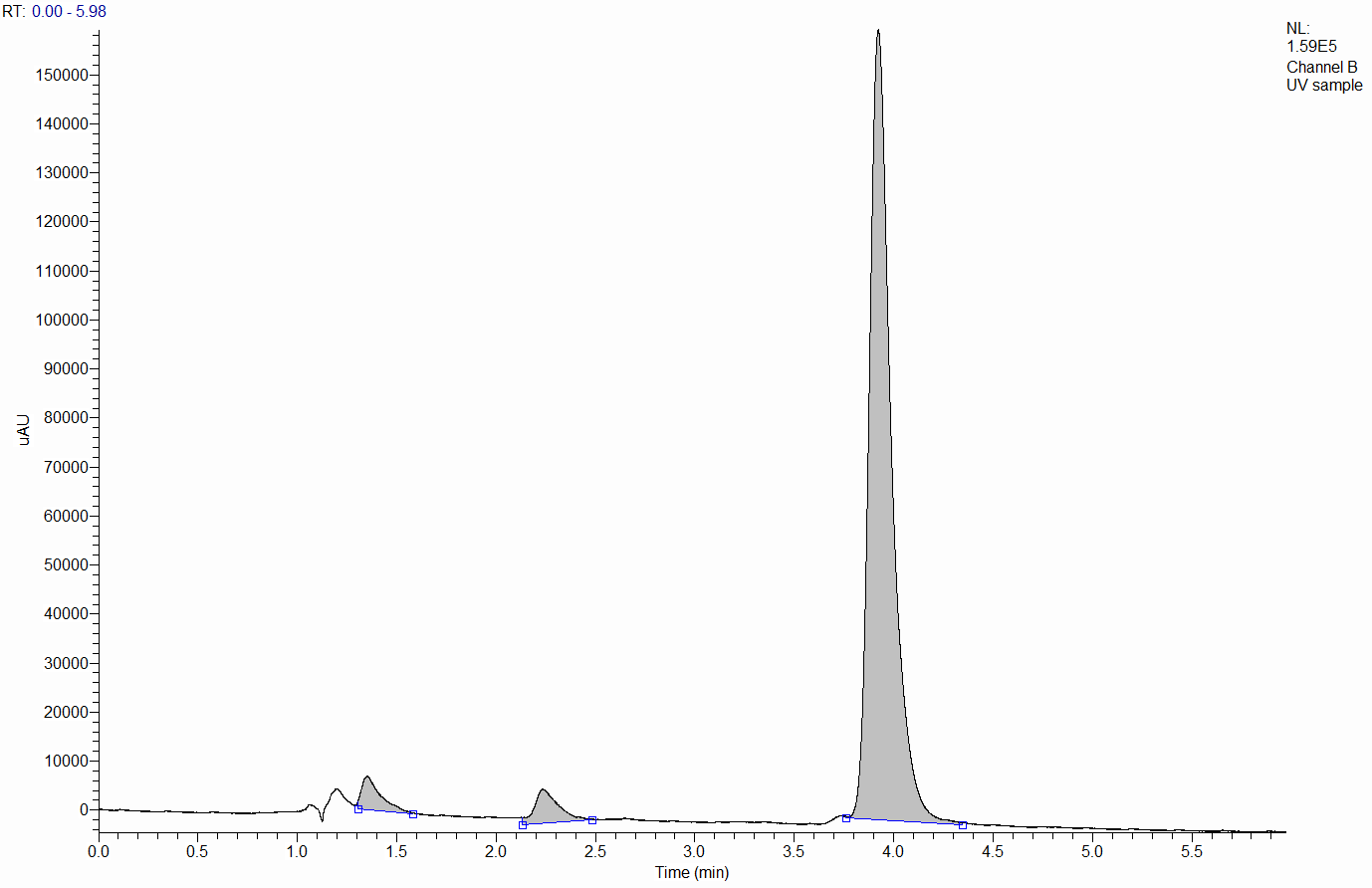
–ис. 8. ’роматограмма препарата Ђ удесанї (услови€ см. в тексте).
¬идно, что в предложенных нами услови€х другие компоненты Ђ удесанї не мешают определению Q10 .
ƒл€ построени€ градуировочной зависимости точную навеску модельного образца массой около 25 мг помещали в мерную колбу, добавл€ли 15 мл изопропилового спирта и тщательно перемешивали. ќбъем доводили до метки ацетонитрилом. ѕолученный раствор с концентрацией 1 мг/мл последовательно разбавл€ли, чтобы получить серию растворов с содержанием коэнзима 0,01; 0,05; 0,1; 0,2; 0,3 и 0,5 мг/мл соответственно. аждый градуировочный раствор анализировали два раза. ѕолученна€ зависимость приведена на рис. 9.
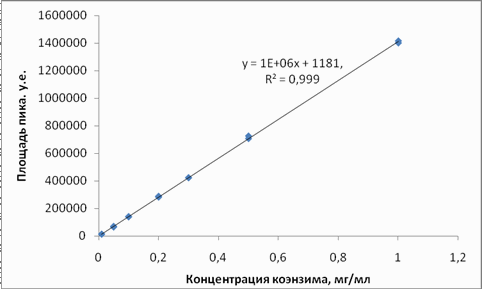
–ис.9. «ависимость площади хроматографического пика коэнзима от его концентрации
«атем проводили регул€рные измерени€ в течение 40 дней. ¬рем€ приема препарата рассчитывали из рекомендуемой суточной дозы (0,5 мл в день). Ѕыли смоделированы следующие ситуации: открыта€ упаковка Ђ удесанї хранитс€ в холодильнике (4∞—), друга€ открыта€ упаковка хранитс€ при комнатной температуре (25 ∞—), треть€ упаковка хранитс€ около батареи (40∞—). –егул€рно проводили анализ содержимого каждой упаковки. ƒл€ точности результата из каждой смеси готовили по три пробы, а дл€ построени€ зависимости считали среднее значение. –езультаты измерений отражены на рисунке 10.
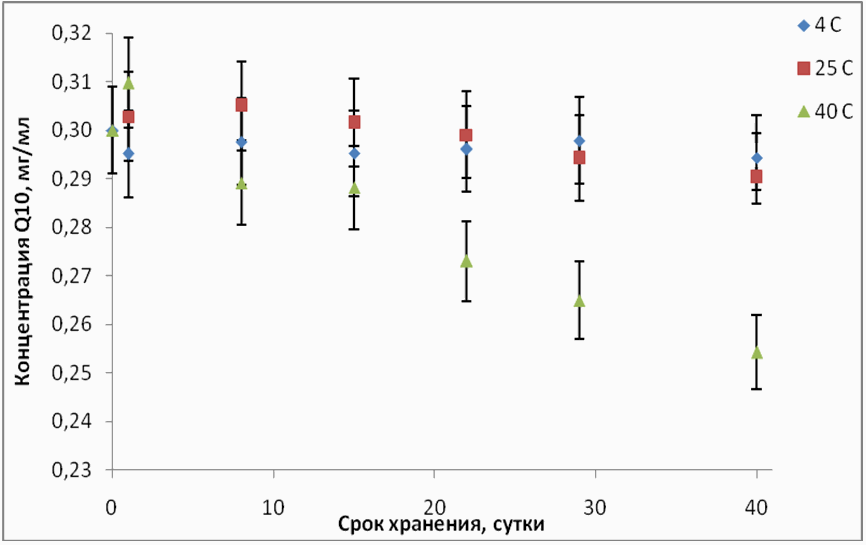
–ис. 10. »зменение концентрации коэнзима Q10 в Ѕјƒ Ђ удесанї в течение 40 дней
Ќа рис. 9 видно, что в Ђ удесанеї, хран€щемс€ при температуре 4 ∞— и 25 ∞—, содержание коэнзима Q10 практически не мен€етс€ (отклонени€ наход€тс€ в пределах погрешности), тогда как при температуре 40 ∞— содержание коэнзима Q10 уменьшилось на 15 %. «начит, при температуре выше комнатной хранить Ѕјƒ Ђ удесанї не следует.
5. «аключение
- ѕодобраны и оптимизированы услови€ хроматографического определени€ коэнзима
Q10 в Ѕјƒ Ђ удесанї: разделение смеси на колонке Luna —18 с использованием подвижной фазы изопропанол C3H7OH: ацетонитрил CH3CN в соотношении 60:40.
ѕостроена градуировочна€ зависимость дл€ Q10: площадь хроматографического пика пр€мо пропорциональна концентрации коэнзима Q10 в диапазоне 0,01 Ц 1 мг/мл.
»зучена стабильность коэнзима Q10 в Ѕјƒ Ђ удесанї при различных услови€х хранени€: при температуре 4 ∞— и 20 ∞— концентраци€ коэнзима Q10 в течение 40 дней практически не изменилась, а при температуре 40 ∞— концентраци€ коэнзима уменьшилась на 15%.
- —писок использованной литературы
[1] ѕашкова ≈.Ѕ., ѕирогов ј.¬., Ѕендрышев ј.ј., Ўпигун ќ.ј. ќпределение коэнзима Q10 и родственных соединений в биологических объектах методом ¬Ё∆’-ћ— // “ез. докладов ¬сероссийского симпозиума Ђ’роматографи€ в химическом анализе и физико-химических исследовани€хї. ћосква, 2007
[2] оферменты. ѕод ред. проф. ¬.ј. яковлева. ћ.: ћедицина, 1973. 377 с.
[ 3] ’имическа€ энциклопеди€. √л. ред. Ќ.—.«ефиров. ћ.: —оветска€ энциклопеди€, 1999. “. 5. —тр. 21-22.
[4] —тыскин ≈.Ћ., »циксон Ћ.Ѕ., Ѕрауде ≈.¬. ѕрактическа€ ¬ысокоэффективна€ ∆идкостна€ ’роматографи€. ћ. 1986. 284 с.
[5] ћедведев ќ.—., √ородецка€ ≈.ј, аленикова ≈.».. ‘армакокинетика коэнзима Q10. Ѕюллетень эксперимаентальной биологии и медицины. 2008. є 9, стр. 281-287.
[6] ѕатент RU 2377019. 01.02.2006 г. “ранспортирующий наполнитель дл€ энтерального применени€.
[7] ’имический энциклопедический словарь. √л. ред. ».Ћ. нун€нц.- ћ.: —оветска€ энциклопеди€, 1983. 792 с.
7. ѕриложение
ѕриложение 1
—одержание коэнзима Q10 в биологических объектах
|
ќбъект |
онцентраци€, мкг/г |
|
Ўпинат |
203 |
|
рыса (почки) |
22,0 |
|
рыса (печень) |
21,3 |
|
рыса (мозг) |
18,9 |
|
урица (мозг) |
17,1 |
|
рыса (сердце) |
16,9 |
|
√ов€жий фарш |
16 |
|
Ѕалтийска€ сельдь |
13 |
|
рыса (селезенка) |
9,2 |
|
рыса (камбаловидна€ мышца) |
6 |
|
ћышь (мозг) |
5,2 |
|
ћышь (сердце) |
5 |
|
ћышечна€ ткань л€гушки |
4,9 |
|
рыса (легкие) |
2,4 |
|
јпельсины |
2 |
|
„еловек (плазма крови) |
0,8 |
ѕриложение 2
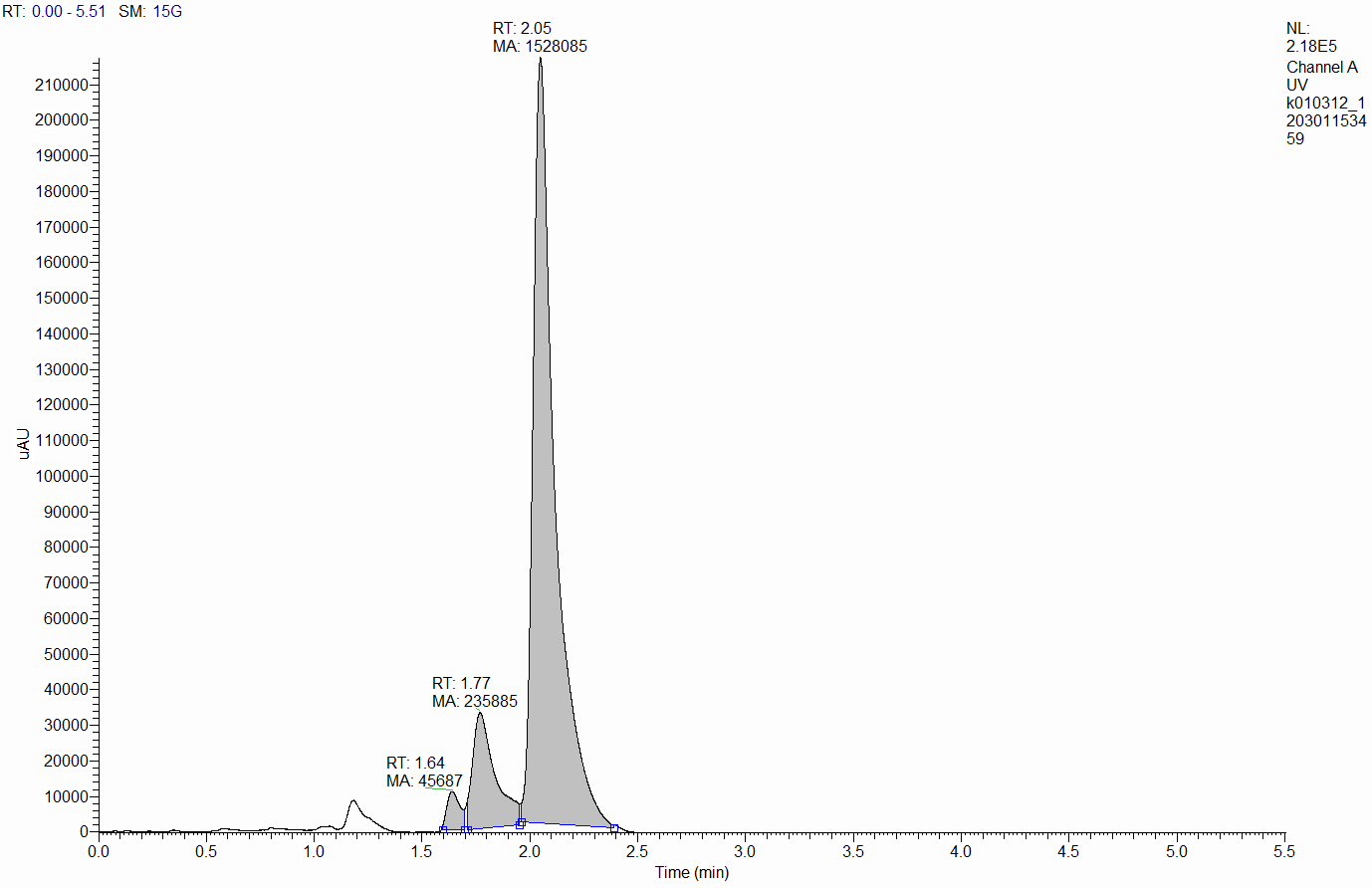
’роматограмма препарата Ђ удесанї. –азбавление в 100 раз подвижной фазой. ѕодвижна€ фаза Ц 80% изопропанола, 20% ацетонитрила.
–убрики (разделы) сайта, содержащие
публикации по проблемам организации
исследовательской и проектной де€тельности
школьников:
Ќа нашем сайте, помимо текущего раздела, есть также три других раздела, также посв€щенные
исследовательской и проектной де€тельности школьников. Ёто раздел ¬ебинары,
посв€щенный вопросам организации исследовательской де€тельности школьников в природе, а также разделы
»сследовательские работы и ѕубликации.
ѕоследние два раздела отличаютс€ от текущего раздела тем, что там собраны детские исследовательские работы и
публикации педагогов по тематике "полевого изучение природы", т.е. исключительно работы, выполненные или описывающие
исследовательскую де€тельность школьников ¬ ѕ–»–ќƒ≈. ƒанный же раздел посв€щен более общим вопросам организации исследовательской и
проектной де€тельности.
¬нимание! Ќа нашем сайте мы готовы публиковать
статьи по вопросам организации экологического
образовани€ детей в природе, которые могут быть полезны
коллегам по всей стране. Ёто могут быть
проблемные статьи, авторские образовательные
программы, методические пособи€,
нормативно-инструктивные документы и материалы,
фотографии, отчеты и т.п. по таким тематикам
как:
- полевые практикумы,
- экологические образовательные экспедиции,
- экологические лагер€,
- конкурсы детских исследовательских работ (проектов),
- материалы семинаров и конференций,
- методики полевых исследований (проектной де€тельности),
- детские исследовательские работы (проекты),
- экологические тропы,
- "экспедиционна€ жизнь".
ќ ¬ас и ¬ашем опыте узнает вс€ –осси€, а
главное - ¬ы сможете принести пользу системе
экологического образовани€ нашей страны,
"вложить свою лепту" в совершенствование
форм и методов работы с детьми!
≈сли ¬ы готовы поделитьс€ своим опытом с
коллегами по всей стране - присылайте
свои предложени€ (кратко опишите свои материалы),
мы рассмотрим их и вместе обсудим наиболее
оптимальную форму их публикации на нашем сайте.
ѕрактикумы
 —еминары
—еминары
 ¬ебинары
¬ебинары
 »сследовательска€ работа
»сследовательска€ работа
 Ёкспедиции и лагер€
Ёкспедиции и лагер€
 Ёкотропы
Ёкотропы
 Ёкологические игры
Ёкологические игры
 ѕубликации
ѕубликации
|







